Nồng độ đương lượng là gì? Công thức tính nồng độ đương lượng…
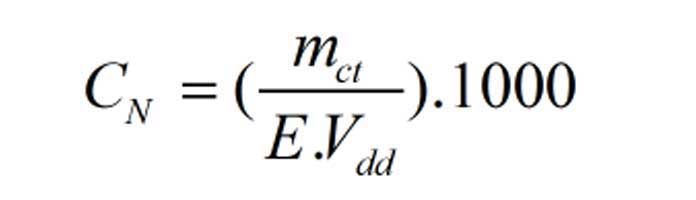
Nồng độ đương lượng là gì?
Đương lượng là đơn vị chức năng giám sát dùng được dùng trong hóa học và sinh học. Đương lượng dùng để thống kê giám sát năng lực một chất tích hợp với những chất khác. Đương lương thường được dùng khi nói về nồng độ chuẩn
Đương lượng của một nguyên tố hay một chất là phần khối lượng nguyên tử hay phân tử tương ứng của một đơn vị hóa trị. Đó là phần khối lượng nhỏ nhất của mỗi chất tác dụng với nhau trong phản ứng hóa học.
Bạn đang đọc: Công thức tính nồng độ đương lượng Cn và ví dụ
Đương lượng gram của 1 chất là khối lượng của chất đó hoàn toàn có thể thay thế sửa chữa hay phản ứng vừa hết với 1 gram hydro .Đương lượng gram của một chất không phải là 1 giá trị nhất định mà nó đổi khác theo từng phản ứng đơn cử .Nồng độ đương lượng còn có tên gọi khác là nồng độ đương lượng gram ,Ví dụ :
Đương lượng gam của oxi là 8, vì nguyên tử khối của oxi là 16, và nó có hóa trị 2 trong các hợp chất.
Đương lượng gam của hiđro là 1, vì nguyên tử khối của hiđro là 1, và nó có hóa trị 1 trong mọi hợp chất phổ biến.
Còn so với những chất phức tạp như axit, bazơ, muối, thì đương lượng được xác địnnh bằng cách lấy phân tử khối của chất đó chia cho số nguyên tử hiđro trong axit, số nhóm OH trong bazơ, số đơn vị chức năng hóa trị dương ( hay âm ) ứng với một phân tử muối .Ví dụ :Nồng độ đương lượng của H2SO4 là 98 : 2 = 49 ( đvC ), vì trongn 1 phân tử H2SO4 có 2 nguyên tử H .
Công thức tính nồng độ đương lượng
Công thức tính nồng độ đương lượng gram
![]()
Trong đó :
- E là đương lượng gram
- n là số mol
- M là khối lượng
Cách để xác lập n là :
- Nếu là axit thì n là số H+ có trong phân tử axit
- Nếu là bazơ thì n là số nhóm OH- có trong phân tử bazơ
- Nếu là muối thì n bằng tổng số hóa trị của các nguyên tử kim loại có trong muối.
- Nếu là chất oxi hóa hoặc chất khử thì n là số electron nhận hay cho của chất đó
Công thức tính nồng độ đương lượng CN
![]()
Trong đó :
- Mm chất tan là khối lượng chất tan nguyên chất (gram)
- E là đương lượng gram của chất
- Vdd là thể tích dung dịch (ml)
- CN là nồng độ đương lượng của dung dịch N nào đó.
Ví dụ : Tính nồng độ đương lượng của dung dịch H2SO4 20 % biết d = 1,14 g / ml .Hướng dẫn :
![]() =4,653
=4,653
Giải thích những bước giải :
+ ![]() %=
%=![]() .100%=
.100%=![]() ,100% (1)
,100% (1)
– Công thức tính nồng độ đương lượng gram là: ![]() =
=![]()
+ Trong đó : E là nồng độ đương lượng gram
M là khối lượng mol
n ( trong trường hợp axit ) là số nguyeent tử H trong axit
⇒ ![]() =
=![]() = 49 (2)
= 49 (2)
– Công thức tính nồng độ đương lượng CN là: ![]() =
=![]() x1000 (3)
x1000 (3)
+ Trong đó : mct là khối lượng chất tan nguyên chấtE là nồng độ đương lượng gramVdd là thể tích dung dịch
⇒ Từ (1), (2), (3) ta có: =![]() .1000=4,653
.1000=4,653
Sotayhoctap chúc các bạn học tốt!
4.5
/
5 ( 2 bầu chọn )
Source: https://camnangbep.com
Category: Học tập
