Trong bài viết dưới đây chúng tôi sẽ liệt kê cho bạn những công thức bạn cần quan tâm và ghi nhớ nó nhé !
Tham khảo bài viết khác:
- Công thức tính áp suất là gì ?
1. Công thức hóa học là gì ?
– Công thức hóa học được dùng để biểu thị thông tin về các nguyên tố có của hợp chất hóa học hoặc đơn chất hóa học. Ngoài ra, nó còn được dùng để diễn tả phản ứng hóa học xảy ra như thế nào.
– Với phân tử, nó là công thức phân tử, gồm ký hiệu hóa học các nguyên tố với số các nguyên tử các nguyên tố đó trong phân tử .
Các kí hiệu của công thức hóa học

2. Các công thức hóa học cần ghi nhớ
1. Công thức tính số mol (n)
– Theo khối lượng : n = m / M ( m là khối lượng, M là phân tử khối )
Theo thể tích ( chất khí ở đktc ) : n = v / 22,4 ( v là thể tích khí )
n = PV / RT, trong đó : P. là áp suất ( atm ), V là thể tích khí ( lít ), R là hằng số = 0,082, T là độ Kenvil = 273 + độ C .
Công thức tính số mol theo nồng độ mol ( M ) : n = CM.V, trong đó : V là thể tích ( lít ), CM là nồng độ mol ( M ) .
2. Công thức tính nồng độ phần trăm
C% = mct/mdd x 100%
Trong đó:
- C%: Nồng độ phần trăm
- mct: Khối lượng chất tan
- mdd: Khối lượng dung dịch
- Mặt khác: mdd = mct + mdm ( mdm là khối lượng của dung môi)
3. Công thức tính nồng độ mol
– Nồng độ mol được tính bằng lượng chất tan ( n ) chia cho thể tích dung dịch ( V )
Công thức tính nồng độ mol: CM = n/Vdd
– Từ công thức tính nồng độ mol ta hoàn toàn có thể suy ra hai công thức khác :
Công thức tính số mol chất tan: n = CM x Vdd
Công thức tính thể tích dung dịch: Vdd = n/CM
4. Công thức tính khối lượng riêng
– Gọi D là khối lượng riêng, ta có công thức tính như sau :
D = m / V
Trong đó:
- D là khối lượng riêng, đơn vị là kg/m3
- m là khối lượng, đơn vị là kg
- V là thể tích, đơn vị là m3
– Từ đó suy ra:
- m = D.V
- V = m / D
Cụ thể, khối lượng riêng tại một vị trí trong vật được tính bằng khối lượng của một thể tích vô cùng nhỏ nằm tại vị trí đó, chia cho thể tích vô cùng nhỏ này.
Một số đơn vị chức năng khác hay gặp của khối lượng riêng là g / cm3 .
5. Công thức tính thể tích dung dịch
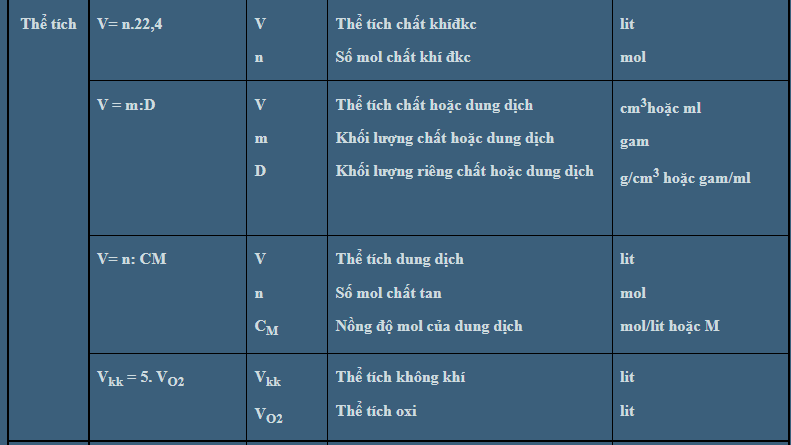
6. Định luât bảo toàn khối lượng
Cho phản ứng : A + B → C + D
Áp dụng định luật BTKL :
mA + mB = mC + mD
7. Tính hiệu suất phản ứng
– Dựa vào 1 trong các chất tham gia phản ứng :
+ H % = ( Lượng thực tiễn đã dùng phản ứng : Lượng tổng số đã lấy ) x 100 %
– Dựa vào 1 trong các chất tạo thành
+ H % = ( Lượng trong thực tiễn thu được : Lượng thu theo lí thuyết ) x 100 %
Trên đây là 1 số ít công thức cơ bản bạn cần quan tâm để tính và vận dụng trong những bài toán dạng khó hơn, nâng cao hơn trong bộ môn hóa học
Hãy chớp lấy những kỹ năng và kiến thức cơ bản nhất để chinh phục được bộ môn hóa này nhé !
5/5 – ( 1 bầu chọn )
Source: https://camnangbep.com
Category: Học tập
