Amoniac (NH3) là một hợp chất vô cơ có tính ứng dụng cao. Do có nhiều ứng dụng nên nó được nghiên cứu, điều chế một cách cẩn thận và tỉ mỉ. Bạn đã biết cách điều chế NH3 trong phòng thí nghiệm chưa? Việc nghiên cứu điều chế trong thí nghiệm giúp chúng ta nhận biết được gì?
Khái niệm về Amoniac (NH3)
Amoniac (NH3) là một trong những hợp chất được con người tìm kiếm qua nghiên cứu trao đổi dinh dưỡng của thực vật. Đây là một hợp chất hữu cơ trong phân tử có chứa 1 nguyên tử Nitơ liên kết đơn với 3 nguyên tử Hidro.
 Bởi vì trong phân tử của hợp chất này còn có một cặp electron hóa trị nên nó hoàn toàn có thể tham gia những phản ứng hóa học khác, link thêm với những nhóm nguyên tử khác .
Bởi vì trong phân tử của hợp chất này còn có một cặp electron hóa trị nên nó hoàn toàn có thể tham gia những phản ứng hóa học khác, link thêm với những nhóm nguyên tử khác .
Trong tự nhiên, Amoniac (NH3) được sinh ra từ hiện tượng sấm sét trước cơn mưa rào, những phân tử Nitơ và Hidro trong không khí sẽ kết hợp với nhau, dưới tác động nhiệt của sét, áp suất không khí.
Bạn đang đọc: Cách điều chế NH3 trong phòng thí nghiệm
Amoniac (NH3) có tính chất vật lý gì?
Theo kiến thức và kỹ năng tổng hợp, Amoniac ( NH3 ) ở điều kiện kèm theo thông thường sẽ ở dạng thể khí, không có màu, có mùi khai đặc trưng, khi hít phải cảm xúc sốc nhẹ. Khí Amoniac ( NH3 ) nhẹ hơn không khí nên khi mở nắp lọ chứa hóa chất, tất cả chúng ta sẽ thấy mùi khai bốc lên nhanh gọn .
Với cấu trúc phân tử, khí Amoniac ( NH3 ) hoàn toàn có thể thuận tiện tan trong nước, để tạo thành dung dịch Amoniac ( NH3 ) .
Amoniac (NH3) có những tính chất hóa học nào?
 Để hiểu rõ hơn về Amoniac ( NH3 ), tất cả chúng ta sẽ điều tra và nghiên cứu những đặc thù hóa học của chúng. Một số phản ứng hóa học bộc lộ đặc thù của Amoniac ( NH3 ) như :
Để hiểu rõ hơn về Amoniac ( NH3 ), tất cả chúng ta sẽ điều tra và nghiên cứu những đặc thù hóa học của chúng. Một số phản ứng hóa học bộc lộ đặc thù của Amoniac ( NH3 ) như :
Đổi màu quỳ tím
Đưa giấy quỳ tím vào khí Amoniac ( NH3 ) ẩm thì rất nhanh quỳ tím sẽ chuyển thành màu xanh .
Phản ứng cháy
Amoniac ( NH3 ) cháy sẽ sinh ra ngọn lửa màu vàng, mẫu sản phẩm tạo ra khí nitơ và hơi nước .
Tác dụng với nước
Đây là một trong những đặc thù hóa học tiên phong của Amoniac ( NH3 ). Khi khí Amoniac ( NH3 ) tan trong nước sẽ phối hợp với ion H + của nước. Từ đó sẽ tạo thành ion amoni NH4 + và ion hiđroxit OH −. Dung dịch Amoniac ( NH3 ) sau đó có tính bazo nhẹ và hoàn toàn có thể dẫn điện .
Phương trình minh họa : NH3 + H2O ⇆ NH4 + + OH –
Tác dụng với axit
Amoniac ( NH3 ) hoàn toàn có thể công dụng axit tạo ra hợp chất muối amoni .
NH3 + HCl → NH4Cl ( khói trắng )
NH3 + H2SO4 → NH4HSO4
NH3 + H2SO4 → ( NH4 ) 2SO4
Tác dụng với các phi kim (thể hiện tính khử)
Amoniac ( NH3 ) bộc lộ tính khử trong những phản ứng với phi kim nổi bật, phim kim mạnh. Ví dụ như :
4NH3 + 3O2 → 2N2 + 6H2 O ( nhiệt độ cao )
4NH3 + 5O2 → 4NO + 6H2 O ( nhiệt độ 800 oC, xúc tác Pt )
2NH3 + 3C l2 → N2 + 6HC l ( nhiệt độ cao )
8NH3 + 3C l2 → N2 + 6NH4 Cl
Tác dụng với oxit kim loại
Amoniac ( NH3 ) khi tính năng với oxit sắt kẽm kim loại sẽ lấy đi oxi, trả lại sắt kẽm kim loại tinh khiết .
3CuO + 2NH3 → Cu + 3H2O + N2
Xem thêm: Trong Không Gian Oxyz, Mặt Phẳng Oxy Có Phương Trình Là Gì, Phương Trình Mặt Phẳng Oxy Có Dạng
Tác dụng với muối
Amoniac ( NH3 ) hoàn toàn có thể tính năng với rất nhiều loại muối sắt kẽm kim loại để tạo ra hợp chất kết tủa .
Phương trình minh họa :
3NH3 + AlCl3 + 3H2 O → Al ( OH ) 3 ( kết tủa ) + 3NH4 Cl
2NH3 + MgCl2 + H2O → Mg ( OH ) 2 + 2NH4 Cl
2NH3 + CuSO4 + 2H2 O → Cu ( OH ) 2 ( kết tủa ) + ( NH4 ) 2SO4
Chú ý : Với muối của Cu, Ag, Zn thì phản ứng sẽ có kết tủa sau đó chuyển thành phức chất tan .
| | Ôn tập kỹ năng và kiến thức :
Cách Điều chế NH3 trong phòng thí nghiệm
Trong phòng thí nghiệm, để điều chế Amoniac ( NH3 ), tất cả chúng ta triển khai bằng cách đun nóng những loại muối amoni. Khi có tác động ảnh hưởng bởi nhiệt độ, những muối sẽ bị phân hủy sinh ra khí Amoniac ( NH3 ) .
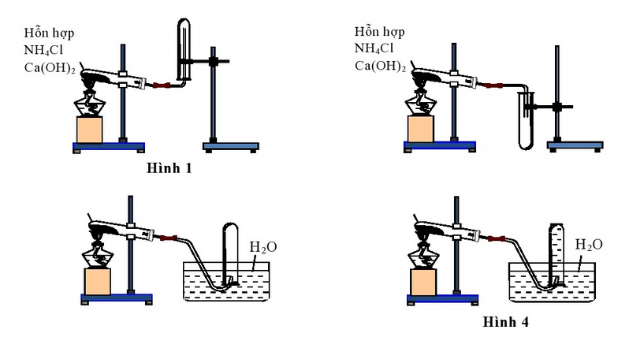
Phương trình điều chế NH3 trong phòng thí nghiệm như sau:
2NH4 Cl + Ca ( OH ) 2 → CaCl2 + 2NH3 ↑ + 2H2 O
Phương pháp điều chế NH3 trong phòng thí nghiệm để thu được khí NH3 khô, không lẫn hơi nước thì chúng ta sẽ cho khí này đi qua bình đựng vôi sống CaO.
| | Xem thêm : Điều Chế HNO3 Trong Phòng Thí Nghiệm
Cách điều chế NH3 trong công nghiệp
Cách điều chế NH3 trong phòng thí nghiệm khá đơn thuần, thu được một lượng khí Amoniac ( NH3 ) nhỏ để ship hàng mục tiêu nghiên cứu và điều tra. Đối với việc sản xuất Amoniac ( NH3 ) số lượng lớn, tất cả chúng ta sẽ sử dụng cách điều chế công nghiệp, cho Nitơ tính năng với Hidro .
N2 ( k ) + 3H2 ( k ) ⇆ to, p, xt2NH3 ( k ) ∆ H < 0
Điều kiện để xảy ra phản ứng là nhiệt độ từ 450 – 500 oC, áp suất 200 – 300 atm, những chất xúc tác phản ứng là : Al2O3, K2O, K2OAl2O3, … Khi thu được khí Amoniac ( NH3 ) tất cả chúng ta thực thi làm lạnh nhanh để thu được nó ở thể lỏng .
Ứng dụng của Amoniac (NH3) trong cuộc sống
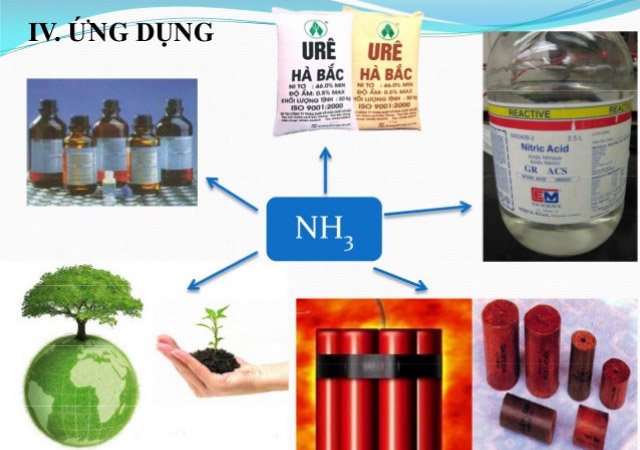 Trong đời sống, Amoniac ( NH3 ) thường được điều chế dùng để :
Trong đời sống, Amoniac ( NH3 ) thường được điều chế dùng để :
- Sản xuất những loại phân bón cho cây cối như : amoni nitrat, phân đạm như urê, amoni sunfat, …
-
Điều chế hidrazin N2H4 (một trong những loại nhiên liệu cho tên lửa)
Xem thêm: [SGK Scan] ✅ Phương trình dường thẳng
- Hóa lỏng để làm chất gây lạnh trong những thiết bị điện lạnh .
Bài viết trên chúng tôi đã gửi đến bạn đọc cách điều chế NH3 trong phòng thí nghiệm cụ thể, tính ứng dụng của NH3 trong thực tế. Chúc các bạn học thật tốt bộ môn Hóa học nhé.
| | Bài viết tương quan khác :
Source: https://camnangbep.com
Category: Học tập
